希少疾患新薬の承認緩和でドラッグロス問題一歩前進へ
厚労省がドラッグロス問題に対処するため、ようやく重い腰を上げました。海外の希少疾患新薬を早期に国内導入するために、日本人への臨床治験なしで承認申請できるように5月から導入する方針とのことです。
世界の希少疾患新薬の開発は欧米のベンチャー企業が先行しているのが実情です。前にも書きましたが、ドラッグロス問題は希少疾患を抱えた患者さんや支えるご家族にとっては病気の進行速度と海外には既に存在する新薬の投与とどちらが早いかで自分の余命が決まるかもしれず、一刻も早い解消を望んでいます。
弊社では、弱いとされている国内勢の新薬開発力の強化を強力に支援するため、経産省の創薬ベンチャー公募の補助金申請を取扱っています。
また、私自身は前職の業務で良質な化学系の特許明細書等も多数読みこなした経験を有しており、新薬製造に関するライセンス契約の締結代理人にもなれます。製薬会社や創薬ベンチャーのみなさん方からのお問い合わせを楽しみにお待ちしています。
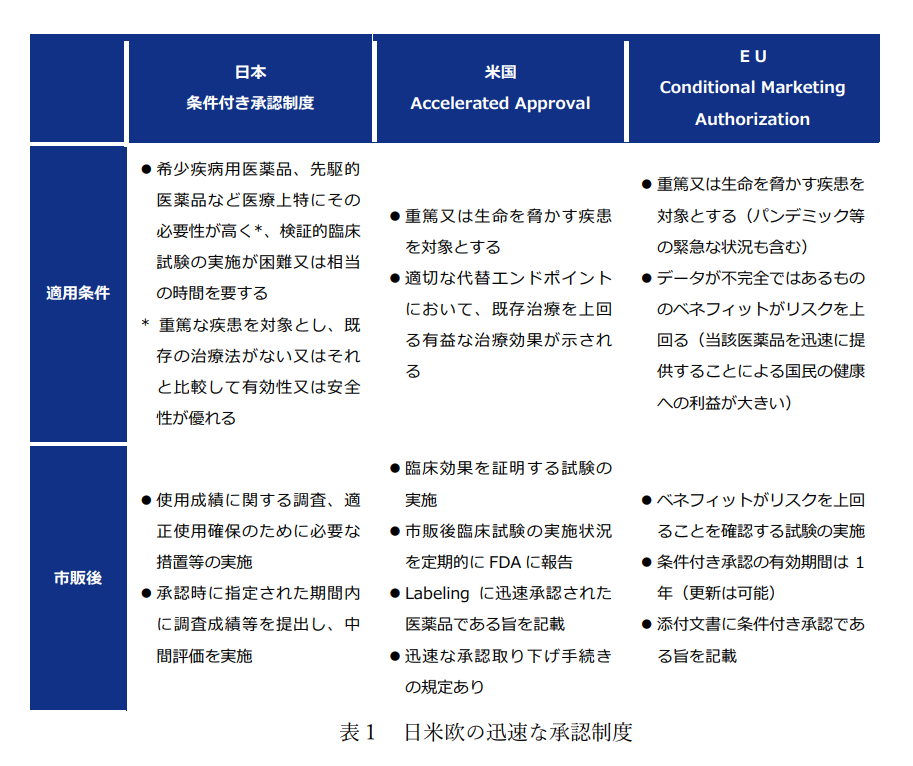
●引用元 厚労省医薬局 創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会 報告書 表1、p22~24
https://www.mhlw.go.jp/content/11121000/001248959.pdf
日本製薬工業協会 国内における治療薬の開発環境や動向に対する考え方や要望https://www.jpma.or.jp/information/industrial_policy/rare_diseases/bbh7c90000000dl6-att/05.pdf
「ドラッグロス」改善へ、希少疾患新薬の申請要件緩和…日本人の臨床試験なしで可能に 読売新聞
https://www.yomiuri.co.jp/medical/20240429-OYT1T50037

